CAR-T细胞疗法研究进展(第41期)
来源:生物谷原创 2024-02-27 11:26
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被 认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实 验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产 生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T 细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1. Bioact Mater:利用涂覆CAR-T细胞膜的纳米颗粒将化疗药物靶向递送到癌细胞
doi:10.1016/j.bioactmat.2023.12.027
为了提高肺癌患者的生存几率,来自美国得克萨斯大学阿灵顿分校和德克萨斯大学西南医学中心的研究人员在一项新的研究中开创了一种直接向癌细胞递送抗癌药物的新方法。相关研究成果发表在2024年4月的Bioactive Materials期刊上,论文标题为“Targeted chemotherapy via HER2-based chimeric antigen receptor (CAR) engineered T-cell membrane coated polymeric nanoparticles”。
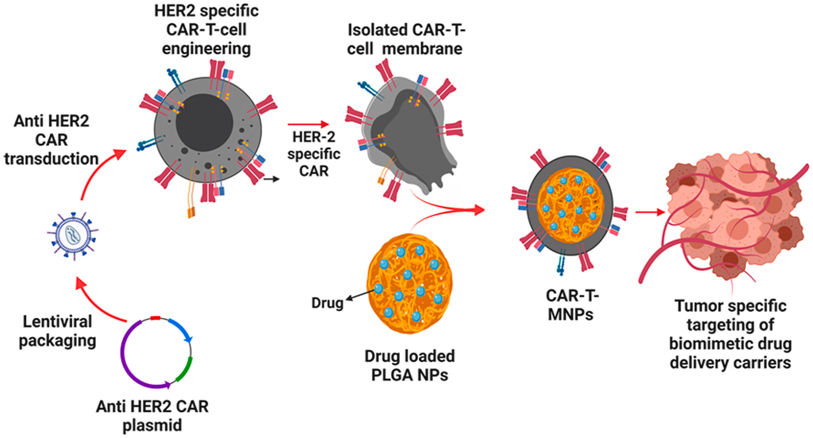
图片来自Bioactive Materials, 2024, doi:10.1016/j.bioactmat.2023.12.027
论文共同通讯作者、 得克萨斯大学阿灵顿分校生物工程教授Kytai T. Nguyen说,“我们的方法利用患者自身的细胞材料作为特洛伊木马,将靶向药物载荷直接递送到肺癌细胞中。这一过程涉及从癌症患者体内分离出T细胞(一种免疫细胞),并对其进行改造,使其表达一种靶向癌细胞的特定嵌合抗原受体(CAR)。”
这项新技术的关键步骤涉及从这些经过改造的T细胞中分离出细胞膜,在细胞膜上装载化疗药物,然后将其涂覆到微小的药物递送纳米颗粒上。这些纳米颗粒的大小约为头发丝的1/100。
当这些涂有细胞膜的纳米颗粒被注射回患者体内时,这种细胞膜就会起到向导作用,将这些纳米颗粒精确地导向肿瘤细胞。这种方法的目的是欺骗患者的免疫系统,因为这些涂有细胞膜的纳米颗粒模拟免疫细胞的特性,避免被人体检测和清除。
2. Science子刊:新研究表明STAb-T 细胞有望比CAR-T细胞更有效地治疗多发性骨髓瘤
doi:10.1126/scitranslmed.adg7962
在一项新的研究中,来自西班牙国家癌症研究中心(CNIO)、12 de Octubre 大学医院、何塞普-卡雷拉斯白血病研究所、巴塞罗那克莱尼茨医院、萨拉曼卡大学和马德里康普顿斯大学的研究人员开发出了一种治疗多发性骨髓瘤的新型免疫疗法。这种新的免疫疗法基于所谓的 STAb-T 细胞。它尚未通过临床试验,因此至少要两年后才能用于多发性骨髓瘤患者。相关研究结果发表在2024年2月14日的Science Translational Medicine期刊上,论文标题为“Causality-enriched epigenetic age uncouples damage and adaptation”。论文通讯作者为H12O-CNIO 癌症免疫疗法临床研究小组负责人Luis Álvarez-Vallina。
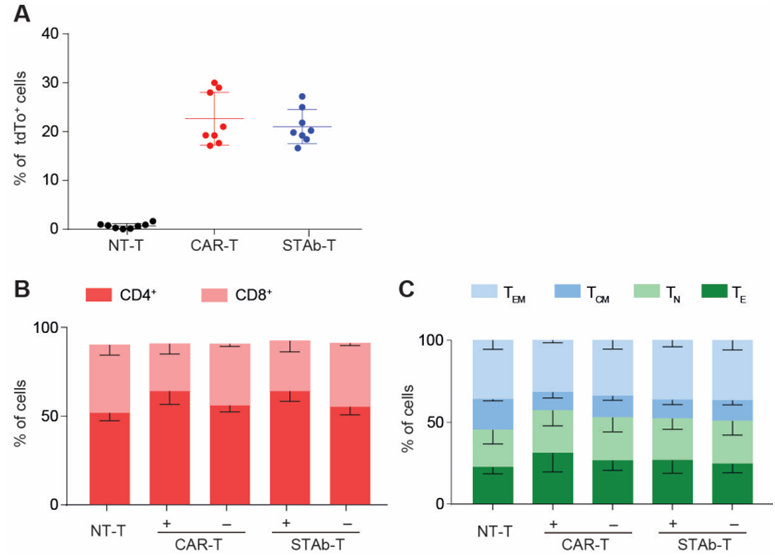
图片来自Science Translational Medicine, 2024, doi:10.1126/scitranslmed.adg7962
CAR-T细胞疗法(嵌合抗原受体T细胞疗法,简称CAR-T)是指在实验室中改造患者的T细胞,使其获得识别和对抗肿瘤细胞的能力。这项新的研究将这种疗法与另一种基于 STAb-T 细胞(经改造后分泌双特异性T细胞接合抗体的T细胞, engineered T cells secreting bispecific T cell engager antibody)的细胞免疫疗法进行了比较。在这两种情形下,这些在实验室中接受过改造的细胞都能识别相同的抗原,即仅存在于肿瘤细胞中的 BCMA。这样,这些经过改造的细胞就只靶向和攻击癌细胞。
他们的研究结果表明,STAb-T 细胞比 CAR-T 细胞更胜一筹,因为它们能招募体内的天然非修饰 T 细胞,使其也能对抗癌细胞,从而扩大了治疗效果。此外,STAb-T 还能克服减缓 CAR-T细胞疗法的一个因素。在一些多发性骨髓瘤患者体内,当肿瘤负荷较高时,用于识别肿瘤细胞的 BCMA 抗原会以可溶性形式存在。他们的新结果显示,这种抗原变得可溶性这一事实阻碍了 CAR-T 细胞的活性,但并不影响 STAb-T 细胞。
3. Nat Commun:靶向TYRP1的CAR-T细胞有望治疗皮肤黑色素瘤和罕见黑色素瘤亚型
doi:10.1038/s41467-024-45221-2
在一项新的研究中,来自美国加州大学洛杉矶分校的研究人员建立并展示了一种旨在专门用于治疗皮肤黑色素瘤和罕见黑色素瘤亚型患者的新型嵌合抗原受体(CAR)T细胞免疫疗法的潜在疗效。相关研究结果于2024年2月9日发表在Nature Communications期刊上,论文标题为“CAR-T cell therapy targeting surface expression of TYRP1 to treat cutaneous and rare melanoma subtypes”。
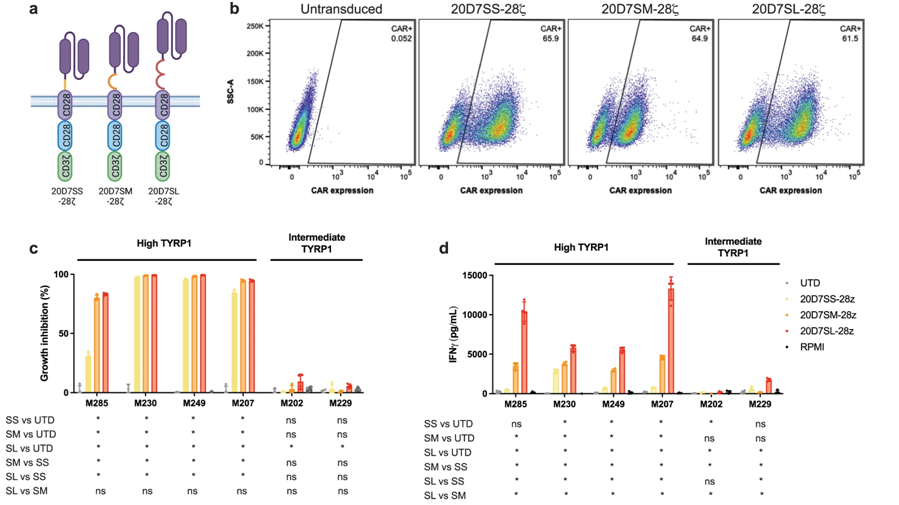
图片来自Nature Communications, 2024, doi:10.1038/s41467-024-45221-2
这篇论文介绍的这种新方法使用了一种经过基因改造的 CAR-T 细胞,它们能识别并攻击含有高水平TYRP1 的细胞,其中TYRP1 是一种在黑色素瘤细胞表面上发现的蛋白。这些作者发现,在临床前测试中,这些经过基因改造的CAR-T细胞能有效消灭癌细胞,而且不会产生严重的副作用。
论文通讯作者、加州大学洛杉矶分校医学院医学助理教授Cristina Puig-Saus博士说,“CAR-T 细胞疗法面临的最大挑战之一是缺乏合适的肿瘤靶点。虽然TYRP1此前在临床试验中一直利用单克隆抗体进行靶向,但这种新方法利用了CAR-T细胞疗法的力量,并带来了非常好的抗肿瘤反应,提高了这种治疗的整体有效性。”
为了找到利用CAR-T细胞免疫疗法治疗黑色素瘤的更好方法,这些作者首先寻找一种抗原,以便用来靶向癌细胞表面上表达但在正常细胞中表达较低的蛋白。通过分析三个不同的黑色素瘤数据集,他们发现了在黑色素合成中起关键作用的TYRP1,它在黑色素瘤细胞表面上的表达比在正常组织中更突出。
他们发现约有 30% 的皮肤黑色素瘤患者存在 TYRP1 的高度过表达。重要的是,在罕见的黑色素瘤患者中,该蛋白过表达的比例甚至更高。他们的研究表明,60%的肢端黑素瘤和粘膜黑色素瘤患者以及约90%的葡萄膜黑色素瘤患者过表达TYRP1。
4. Nat Med:临床研究表明靶向CD19的脐带血衍生CAR-NK细胞有望治疗多种B细胞恶性肿瘤
doi:10.1038/s41591-023-02785-8
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员报告了一项I/II期临床试验---37名复发性或难治性B细胞恶性肿瘤患者接受了靶向CD19的脐带血衍生嵌合抗原受体(CAR)自然杀伤(NK)细胞疗法---的良好结果。他们的结果显示在治疗100天后的总反应率为48.6%,一年无进展生存率和总生存率分别为32%和68%。该临床试验报告了极佳的安全性,没有出现严重的细胞因子释放综合征、神经毒性或移植物抗宿主疾病。相关研究结果于2024年1月18日在线发表在Nature Medicine期刊上,论文标题为“Safety, efficacy and determinants of response of allogeneic CD19-specific CAR-NK cells in CD19+ B cell tumors: a phase 1/2 trial”。
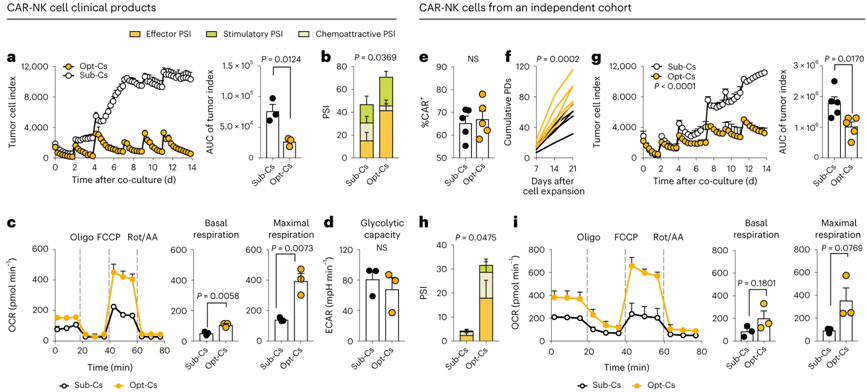
图片来自Nature Medicine, 2024, doi:10.1038/s41591-023-02785-8
这项临床试验的另一个重要发现是异体脐带血供者的选择标准在 CAR-NK 细胞制造中的重要性。在采集后24小时内冷冻保存的脐带血单位和有核红细胞含量低的脐带血单位与明显更好的结果相关。由这些脐带血单位产生的 CAR-NK 细胞的一年无进展生存率为 69%,总生存率为 94%,相比之下,有核红细胞含量较高或从采集到冷冻保存时间较长的脐带血单位产生的 CAR-NK 细胞的一年无进展生存率为 5%,总生存率为 48%。
论文通讯作者、德克萨斯大学MD安德森癌症中心干细胞移植与细胞疗法教授Katy Rezvani博士说,“在我们继续评估CAR-NK细胞治疗这些恶性肿瘤的长期疗效时,在这些患者身上观察到的反应非常令人鼓舞。为了获得成功的异体细胞疗法,我们还必须确定用于CAR-NK细胞制造的最佳异体供者的特征。我们能够确定与最有可能产生积极临床反应的脐带血单位相关的两个关键因素,并找出了这一现象背后的生物机制。”
这项临床研究还指出对不同类型的B细胞恶性肿瘤都有令人鼓舞的反应率。低级别非霍奇金淋巴瘤患者治疗30天后的总反应率为100%,未转化的慢性淋巴细胞白血病患者的总反应率为67%,弥漫大B细胞淋巴瘤(DLBCL)患者的总反应率为41%。
5. Nat Biotechnol:科学家有望对CAR-T细胞成功增压来开发高效靶向性抗癌疗法
doi:10.1038/s41587-023-02060-8
嵌合抗原受体(CAR)T细胞疗法在治疗多种造血系统恶性肿瘤中的成功很难在实体瘤中复制,部分原因是T细胞的耗竭以及最终的功能障碍。近日,一篇发表在国际杂志Nature Biotechnology上题为“IL-10-expressing CAR T cells resist dysfunction and mediate durable clearance of solid tumors and metastases”的研究报告中,来自瑞士洛桑联邦理工学院等机构的科学家们通过研究在癌症疗法研究方面取得了重大进展,在实验室环境中,这种创新性的CAR-T细胞疗法在小鼠模型中就能持续根除癌变肿瘤。

科学家有望对CAR-T细胞成功增压来开发高效靶向性抗癌疗法
图片来源:Nature Biotechnology (2024). DOI:10.1038/s41587-023-02060-8
此外,在正在进行的临床试验中,11名患者似乎就能利用这种疗法实现疾病的完全缓解,且迄今为止治疗的成功率达到了100%;值得注意的是,本文研究证据表明,这种疗法具有长期的有效性且其制造过程或许要比目前的方法更快,且成本效益更高。CAR-T细胞疗法的核心就是修饰T细胞从而靶向作用并消除特定癌细胞,这些经过修饰的T细胞配备了前和抗原受体(CARs),从而就能使其识别并锁定癌细胞,这就揭示了其相比传统疗法的重大区别。
研究者Tang说道,我们在CAR-T细胞疗法的基础上又增加了一层,即通过生物工程技术制造出一种更强大的增压免疫细胞,从而使其在靶向作用并摧毁肿瘤细胞方面特别有效。我们的的研究为这种创新性方法又增加了另一个维度,传统的CAR-T细胞尽管对于液体癌症有效,但在实体瘤治疗方面却面临诸多挑战,即细胞会自我损耗且最终无法完全摧毁癌细胞。
这项研究中,研究人员引入了CAR-T细胞,其能分泌IL-10分子,从而就会被修饰过的T细胞所吸收,换句话说,细胞已经被工程化改造成为能产生自己的药物,且在肿瘤的恶劣环境中能保持健康状态。让研究人员惊讶的是,传统上认为IL-10能作为一种免疫抑制剂,但这项研究中,研究人员利用了其特殊的代谢强化能力,而不是能抑制免疫反应的能力,这种创新性的转变就会促进CAR-T细胞的代谢,而这些代谢强化疗法对现有的肿瘤也能发挥作用,并能防止未来肿瘤的复发。即使在肿瘤细胞被引入到小鼠模型后,这些细胞也无法自我建立或者显示出任何恶性肿瘤,这就强调了疗法的持久功效,即免疫反应应该保持警惕,从而就能有效中和任何新的癌症威胁;研究人员认为这种新型技术或有望能挽救患者的生命,就像迄今为止在本文中的12名患者身上进行试验那样。
6. Blood:针对T细胞淋巴瘤患者的新型CAR-T细胞疗法在I期临床试验中展现出巨大希望
doi:10.1182/blood.2023022204
近日,一篇发表在国际杂志Blood上题为“Anti-tumor Efficacy and Safety of Unedited Autologous CD5.CAR T cells in Relapsed/Refractory Mature T-cell Lymphomas”的研究报告中,来自休斯顿卫理公会医院等机构的科学家们通过研究开发了一种新型的嵌合抗原受体(CAR)T细胞疗法来靶向治疗T细胞淋巴瘤,T细胞淋巴瘤是一种侵袭性且难以治疗的人类癌症。文章中,研究人员在一项针对复发性或难治性T细胞淋巴瘤患者的首个人类1期临床试验中发现了抗肿瘤疗效和安全性的早期信号。
研究者表示,试验中的所有患者在接受研究性的CAR-T细胞治疗之前都接受了其它疗法的广泛治疗,9名患者中有4名(44%)都出现了临床反应,2名患者都达到了疾病完全缓解,第三名患者最初表现出了不同的反应,随后接受了第二次CAR-T细胞的输注,并进行了异体造血干细胞的移植,在接受CAR-T细胞疗法5年后,该名患者目前处于疾病缓解期,第四名患者表现出了部分治疗反应,这些接受治疗的患者中没有出现严重的副作用,仅表现为最常见的副作用,比如细胞减少症等,但大多数症状都自行缓解了。
研究者LaQuisa Hill说道,这些研究发现非常鼓舞人心,如今我们已经证明利用CAR-T细胞疗法来靶向作用T细胞恶性肿瘤是可行的,而且接受这种疗法具有很好的安全性,几乎没有严重的毒性作用,患者可以在门诊环境中接受治疗,而且也不会因为治疗而感到不舒服。复发性或难治性T细胞淋巴瘤或白血病患者的治疗预后较差,因为当前可用的疗法往往并不是长期有效的;CAR-T细胞疗法如今在B细胞恶性肿瘤治疗中能表现出一定的疗效,目前有6种CAR-T细胞产品已经上市,但尚未批准用于T细胞恶性肿瘤的治疗。
7. Science子刊:新研究揭示PC-CAR识别肿瘤靶标的结构原理,有助于指导新型CAR-T细胞疗法设计
doi:10.1126/sciimmunol.adj5792
嵌合抗原受体(CAR)为罕见和难以治疗的癌症开辟了一个令人兴奋的新治疗领域,因为它们能够提供杀死肿瘤细胞的靶向疗法。以肽为中心的 CAR(peptide-centric CAR, PC-CAR)依赖于来自细胞内由潜在致癌基因产生的蛋白的特定肽“条形码”,旨在发现和靶向癌细胞。这些肽条形码由人类白细胞抗原(HLA)显示,从而帮助免疫系统区分自身蛋白和病毒等外来入侵者。然而,HLA源自最为“多态性”的基因,有超过25000个等位基因,编码执行基本功能的蛋白的DNA——它们之间可能存在差异,因此很难设计出针对与不同癌症相关的特定等位基因的PC-CAR。
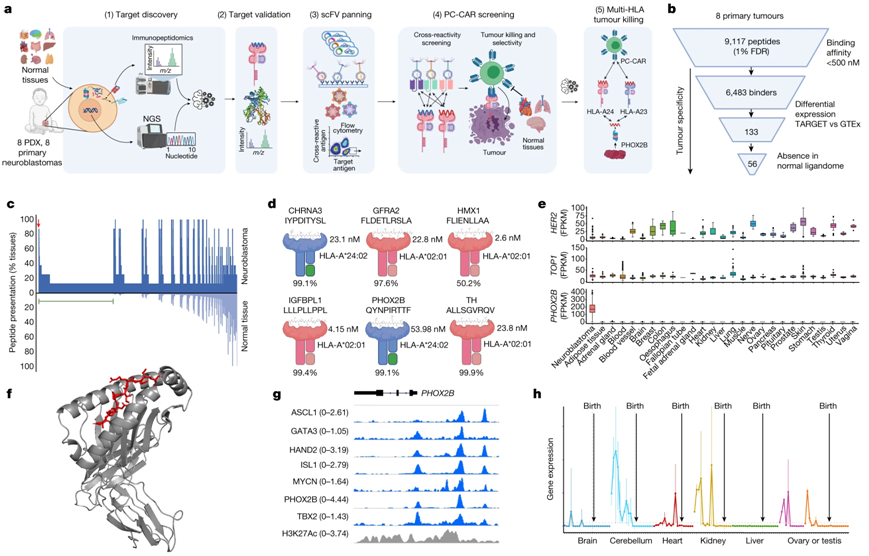
图片来自Nature, 2023, doi: 10.1028/s41586-023-06706-0
如今,在一项新的研究中,来自美国费城儿童医院的研究人员解析出一种三维蛋白结构,解释了 PC-CAR 如何识别这些 HLA 复合物的“骨架”。这些结构信息将使得人们能够了解CAR如何识别不同多态性HLA等位基因中的肿瘤相关抗原,从而为针对更复杂、更难治疗的肿瘤设计精准医疗策略提供更多可能性。相关研究结果发表在2023年12月的Science Immunology期刊上,论文标题为“Structural principles of peptide-centric chimeric antigen receptor recognition guide therapeutic expansion”。
论文通讯作者、费城儿童医院计算与基因组医学中心副教授Nikolaos G. Sgourakis博士说,“如果CAR不能正确匹配,以靶向与某些癌症相关的特定等位基因,就有可能在不提供任何治疗益处的情况下诱发毒性。通过观察它们的三维复杂结构,我们可以利用这些发现设计出能够靶向多种HLA的CAR,从而提高治疗设计的效率。”
早期的CAR疗法只能靶向肿瘤细胞表面上的癌症特异性抗原,而这些抗原大多也存在于细胞内。然而,人们已发现,这些以前无法接触的靶标最终会降解成肽,这些肽可以像“条形码”一样在细胞表面上呈现,然后成为治疗靶标。即便如此,由于 HLA 等位基因的变异性如此之大,CAR疗法可能只能帮助一小部分肿瘤患者,这取决于肿瘤细胞表面呈现哪些肽。
8. Nature子刊:含有亮氨酸拉链基序的模块化嵌合细胞因子受体可提高 CAR-T 细胞的抗肿瘤活性
doi:10.1038/s41551-023-01143-w
使用经过修饰的嵌合抗原受体(CAR)T 细胞(CAR-T)的免疫疗法大大提高了复发性白血病儿童患者的生存率。然而,这些疗法在治疗实体瘤方面并不那么有效,而且可能有很大的毒性。在一项新的研究中,来自美国圣犹达儿童研究医院的研究人员发现,在 CAR-T 细胞中加入一种模块化嵌合细胞因子受体可提高它们在多种实体肿瘤模型中的疗效。相关研究结果于2023年11月30日在线发表在Nature Biomedical Engineering期刊上,论文标题为“Modular chimeric cytokine receptors with leucine zippers enhance the antitumour activity of CAR T cells via JAK/STAT signalling”。

图片来自Nature Biomedical Engineering, 2023, doi:10.1038/s41551-023-01143-w
论文第一作者Matthew Bell说,“我们设计了模块化嵌合细胞因子受体,并证明它们能改善CAR-T细胞。从我们的模型来看,这种技术有可能广泛改善CAR-T细胞治疗实体瘤和脑瘤的效果。”
CAR-T 细胞是患者自身的免疫细胞经过修饰后可靶向杀死癌细胞。实体瘤产生的抗免疫信号会关闭CAR-T细胞,从而降低治疗效果。为了解决这个问题,科学家们将CAR-T细胞与细胞因子注射结合起来,然而这种细胞因子注射可能会造成严重的意外毒性。这些作者开发的新方法允许他们仅向 CAR-T 细胞递送细胞因子的促免疫信号,从而消除了全身毒性。
Bell说,“我们的方法仅将细胞因子信号的作用限制在经过修饰的CAR-T 细胞上。反过来,这也降低了细胞因子相关毒性的几率,并提供了这些 CAR-T 细胞在抑制性肿瘤微环境中有效发挥作用所需的信号。”
9. Cell子刊:作为CAR-T细胞疗法有希望的蛋白靶标竟帮助实体瘤欺骗免疫系统
doi:10.1016/j.xcrm.2023.101297
在一项新的研究中,来自美国圣犹达儿童研究医院的研究人员使癌症免疫疗法离治疗诸如脑瘤之类的实体瘤更近了一步。他们在原理验证实验中验证了一种靶向GRP78蛋白的细胞免疫疗法。相关研究结果发表在2023年11月21日的Cell Reports Medicine期刊上,论文标题为“GRP78-CAR T cell effector function against solid and brain tumors is controlled by GRP78 expression on T cells”。
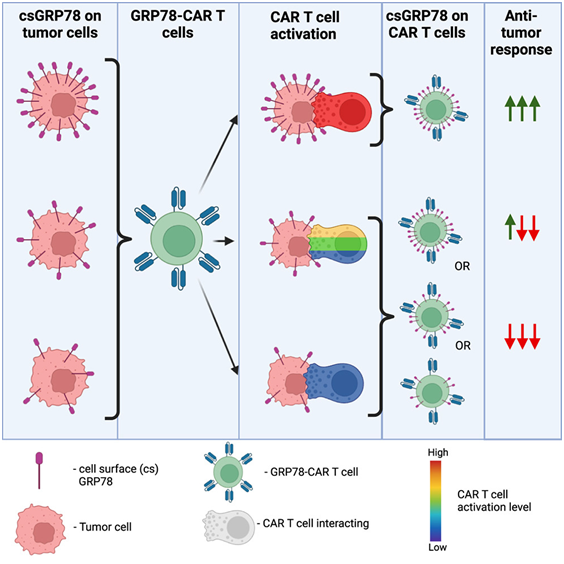
图片来自Cell Reports Medicine, 2023, doi:10.1016/j.xcrm.2023.101297
这些作者还发现了一种抵抗性机制,即某些肿瘤会诱使杀死癌症的免疫细胞表达GRP78,从而关闭免疫细胞或导致它们也被杀死。这一发现对开发靶向多种表达GRP78的难治性脑瘤和实体瘤的免疫疗法具有重要意义。
论文共同通讯作者、圣犹达儿童研究医院骨髓移植与细胞治疗科的Giedre Krenciute博士说,“我们发现GRP78是CAR-T细胞的一种很好的靶标。我们在多种脑瘤和实体瘤类型中观察到了较高的GRP78表达,包括成人胶质母细胞瘤、弥漫性内生性桥脑胶质瘤(DIPG)、骨肉瘤、三阴性乳腺癌和尤文肉瘤,但我们的疗效却不尽相同。”
这些作者开发的靶向GRP78的CAR-T 细胞在细胞模型和小鼠模型中都成功杀死了多种类型的癌症,但差异很大。他们预计,较高水平的GRP78(更多的蛋白可被靶向)会使CAR-T细胞更容易定位和摧毁癌症;然而,事实并非如此。他们发现,GRP78的含量与CAR-T细胞杀死癌症的能力之间没有关系。
10. Ann Intern Med:新研究表明利用CAR-T细胞疗法axi-cel和liso-cel治疗弥漫大B细胞淋巴瘤并不具有成本效益
doi:10.7326/M22-2276
根据一项新的研究,对于弥漫大B细胞淋巴瘤(DLBCL)患者来说,嵌合抗原受体T细胞疗法(CAR-T)axicabtagene ciloleucel (axi-cel)和lisocabtagene maraleucel (liso-cel)并不划算。相关研究结果于2023年12月5日在线发表在Annals of Internal Medicine期刊上,论文标题为“Second-Line Chimeric Antigen Receptor T-Cell Therapy in Diffuse Large B-Cell Lymphoma”。
美国丹娜-法伯癌症研究所Amar H. Kelkar医学博士及其同事们在状态转换微观模拟模型中研究了二线CAR-T细胞疗法与挽救性化学免疫疗法和巩固性自体干细胞移植(ASCT)治疗DLBCL的成本效益。目标人群是DLBCL“高危”患者。
这些作者发现,在基础病例分析中,axi-cel和liso-cel的中位总生存期分别增加了4个月和1个月。axis-cel和liso-cel的增量成本效益比(incremental cost-effectiveness ratio)分别为每个质量调整生命年(quality-adjusted life year, QALY)684,225美元和1,171,909美元。相应的增量净货币效益(incremental net monetary benefit)分别为 -107 642美元和 -102 477美元。
在敏感性分析中,在每个QALY的支付意愿阈值为20万美元的情况下,CAR-T细胞疗法axi-cel和liso-cel的成本需要分别降低到321,123美元和313,730美元。在5年的时间里,在高风险患者中实施CAR-T细胞疗法将使美国的医疗保健支出增加约68亿美元。
11. Mol Cancer:1期临床试验表明一种新型CAR-T细胞疗法有望治疗B细胞非霍奇金淋巴瘤
doi:10.1186/s12943-023-01886-9
作为一种新型CAR-T细胞疗法,AT101采用一种独特的结合机制来靶向CD19。在一项新的研究中,来自美国宾夕法尼亚大学的研究人员指出针对AT101的一项I期临床试验的早期结果显示,在该临床试验中研究的较高剂量水平下,完全缓解率为100%。相关研究结果于2023年12月9日发表在Molecular Cancer期刊上,论文标题为“Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin lymphoma: a first-in-human study”。
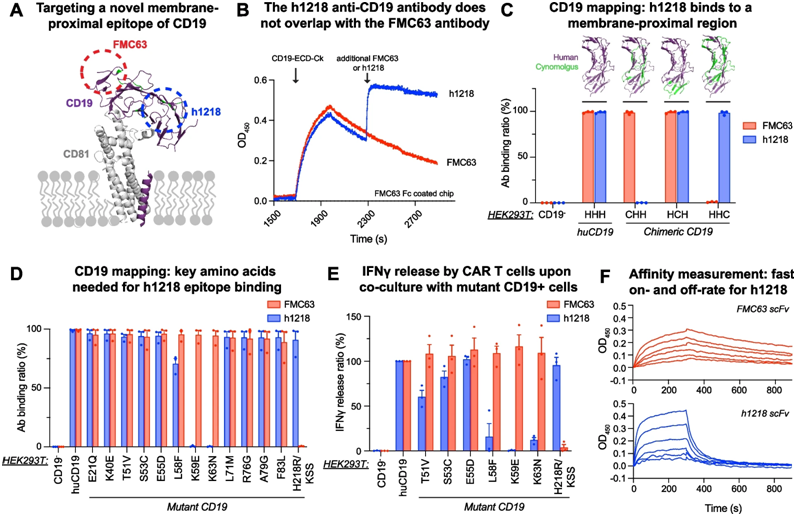
h1218抗体对CD19具有特异性,可识别非FMC63的膜近端表位
图片来自Molecular Cancer, 2023, doi:10.1186/s12943-023-01886-9
CAR-T细胞疗法彻底改变了对许多已没有其他治疗选择的血癌患者的治疗。虽然有些患者对CAR-T细胞疗法产生了长期反应,但对另一些患者却不起作用,或者说他们的癌症最终复发。目前获批的 CD19 CAR-T 细胞疗法都通过相同的表位(FMC63)靶向 CD19,下称FMC63-CART19。
为了让 CD19 CAR-T 细胞疗法对更多患者更有效,宾夕法尼亚大学血液肿瘤学助理教授医学博士Marco Ruella和他的研究团队与韩国 AbClon 公司合作通过使用来自相同患者的细胞,开发了一种 CAR-T细胞产品(AT101):AT101通过一种新型抗体靶向CD19中位于细胞膜附近的不同表位(h1218),下称h1218-CART19。
在临床前研究中,这些作者已证实与 FMC63-CART19 相比,h1218-CART19 能减少 T 细胞衰竭并改善疾病控制。
这项首次在人体中开展的I期临床试验(NCT05338931)在韩国进行,共招募了12名复发或难治性B细胞非霍奇金淋巴瘤患者。该研究旨在提高 AT101 的剂量水平,因为前六名患者的安全性已得到确认。在中位随访6.5个月后,接受2级或更高剂量治疗的6名患者均获得了完全缓解,而且他们的癌症没有复发。
12. Blood:第三代anti-CD19 CAR-T细胞在治疗B细胞非霍奇金淋巴瘤的1期临床试验中显示出疗效,并且没有神经毒性
doi:10.1182/blood-2023-178872
在一项新的研究中,来自新西兰马拉汉医学研究所和惠灵顿昭泰治疗有限公司(Wellington Zhaotai Therapies Limited)的研究人员公布了新型第三代抗 CD19 嵌合抗原受体 (CAR) T 细胞(anti-CD19 CAR-T细胞)疗法的1期剂量递增临床试验结果。相关研究结果于2023年11月28日在线发表在Blood期刊上,论文标题为“A Phase 1 Dose Escalation Trial of Third-Generation CD19-Directed CAR T-Cells Incorporating CD28 and Toll-like Receptor 2 (TLR2) Intracellular Domains for Relapsed or Refractory B-Cell Non-Hodgkin Lymphomas (ENABLE)”。
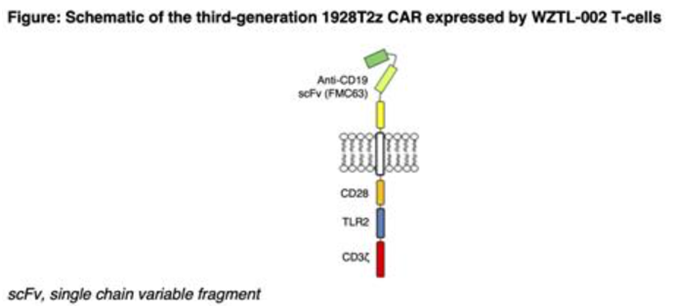
图片来自Blood, 2023, doi:10.1182/blood-2023-178872
具有CD28协同刺激结构域的anti-CD19 CAR-T细胞,比如axicabtagene ciloleucel和brexucabtagene autoleucel,是治疗B细胞非霍奇金淋巴瘤最有效的CAR-T细胞疗法之一,但大约一半的受者会出现神经毒性(immune effector cell-associated neurotoxicity syndrome, ICANS, 免疫效应细胞相关神经毒性综合征),高达90%的受者会出现细胞因子释放综合征(cytokine release syndrome, CRS)。
这些作者开发出第三代自体anti-CD19 CAR-T细胞产品,该产品将 CD28 与TLR2共刺激结构域结合在一起。在临床前研究中,与仅有 CD28 协同刺激的 CAR 相比,添加 TLR2共刺激结构域的anti-CD19 CAR-T细胞产品保持或提高了疗效,同时降低了促炎细胞因子 IFN-γ 和 GM-CSF 的产生,而这两种细胞因子与 CRS 和 ICANS 有关联。
21名复发或难治性B细胞非霍奇金淋巴瘤患者在1期临床试验的剂量递增队列中接受了治疗,并完成了主要随访期。患者年龄中位数为57岁,19%为毛利人,之前平均接受过四种疗法。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


